Планетарная модель атома и постулаты Бора
На этой странице вы узнаете
- Почему пудинг с изюмом не нравится физикам?
- Возможна ли телепортация в реальном мире?
- Как труды Менделеева были обесценены безобидной шуткой?
Мы с вами живем в макромире, где действуют классические законы физики. Здесь яблоки всегда падают вниз, а пудинг с изюмом — это еда. Но все меняется, когда мы переходим в микромир. Для мельчайших частиц не работают привычные законы, а, например, электроны и вовсе способны телепортироваться. Удивительному и невероятному миру частиц микромира, а именно атомам, и будет посвящена эта статья.
Строение атома
Людей веками интересовало, что лежит в основе всего. Каждый предмет, будь то жидкое тело, твердое или газ, состоит из одних и тех же мельчайших частиц, которые невозможно увидеть. Долгое время считалось, что эти маленькие составляющие неделимы, а потому они получили название атомы (с др.греч. «неделимый»). Люди до сих пор не знают, как на самом деле выглядят атомы. Все, на что мы опираемся — это лишь модели.

Чтобы представить размеры атома, можно привести следующий пример. Представьте, что вся наша Земля заполнена яблоками. Так вот. Столько яблок, сколько может поместиться в Земле, столько атомов может поместиться в одном яблоке. Можно привести следующую пропорцию:
\(\frac{Размер Земли}{Размер яблока}=\frac{Размер яблока}{Размер атома}\)
В силу малости размера атома измерять его геометрические характеристики в метрах становится совершенно не информативно. По этой причине в микромире используется такая величина, как ангстрем, равная \(10^{-10}\)м. Ангстрем принято обозначать как Å. Кроме того, для измерения размера атомов используют фемтометры (\(1\) фм \(= 10^{-15}\)м). Тогда ангстрем можно сравнить с фемтометрами следующим образом: \(1\) Å\(= 100 000\) фм.

Атом — самая маленькая часть химического элемента, состоящая из ядра и орбит, по которым движутся электроны.

Рассмотрим каждую составляющую атома подробнее:
- Ядро — место, в котором сосредоточена основная масса атома. Ядро обладает положительным зарядом. В ядре содержатся нейтроны и протоны, или нуклоны.
- Протон — положительно заряженная элементарная частица. Заряд протона равен: \(e = 1,6*10^{-19}\) Кл.
- Нейтрон — элементарная частица, не имеющая заряда. Нейтрон обладает такой же массой, как и протон. \(M = 1,67*10^{-27}\) кг.
- Нуклоны — общее название протонов и нейтронов.
- Электрон — отрицательно заряженная элементарная частица. Имеет заряд \(e = -1,6*10^{-19}\) Кл и массу в 1000 раз меньше, чем протон.
- Орбиты — траектории вокруг ядра, по которым вращаются электроны.

На рисунке представлена планетарная модель Резерфорда, которая в наше время считается единственно правильной. Однако некоторое время считалось, что атом имеет другую модель — модель с кодовым названием «Пудинг с изюмом», предложенную Дж. Томсоном.
| Почему пудинг с изюмом не нравится физикам? Пудинг с изюмом — модель атома, которая был предложена Дж. Томсоном. Предполагалось, что у электронов не было своей орбиты. Они находились в некотором веществе, которое целиком компенсировало отрицательный заряд электронов. При этом сами электроны располагались хаотично. Но в дальнейшем эта модель атома была признана неверной. Ее сместила планетарная модель атома Резерфорда. |

Несмотря на колоссальное различие подходов, понадобилось много времени, чтобы опровергнуть модель «Пудинг с изюмом» Томпсона. Доказательством несостоятельности этой модели стал эксперимент Э. Резерфорда и его учеников. Обсудим его подробнее.
Опыт Резерфорда по рассеянию альфа частиц
Давайте вместе обсудим, как Эрнесту Резерфорду удалось доказать, что модель пудинга Томпсона не имеет ничего общего с реальной структурой атома.
В 1911 году Э. Резерфорд вместе со своими учениками построили установку для изучения распределения заряда и массы внутри вещества. Для этого вокруг тонкой металлической фольги, облучаемой потоком -частиц, был установлен круговой экран. Вещество, из которого он был изготовлен, позволяло фиксировать попадание -частицы вспышкой экрана. Схематически установка выглядела следующим образом:

Круговая форма экрана не была первоначальной идеей установки, а появилась лишь в одной из модернизаций, когда ученые на всякий случай решили исследовать полную картину происходящего. Тем не менее это решение привело к неожиданным результатам. Оказалось, что некоторые частицы рассеиваются на углы, близкие к 180 градусам. Это означало, что вся имеющаяся в атоме масса должна сосредотачиваться в очень маленьком объеме, только тогда она сможет отразить тяжелую -частицу. Место сосредоточения этой массы Э. Резерфорд назвал ядром.
Опыт Э. Резерфорда также показывал, что многие частицы пролетают фольгу беспрепятственно, то есть фиксируются экраном без изменения их движения. Это подтверждало тот факт, что масса сосредоточена в ограниченной маленькой области, вокруг которой расположена «пустота». По картине рассеянных частиц ученые также смогли показать, что ядро является положительным, ведь пролетающие близко к нему положительные -частицы способны отклоняться от своей траектории на углы, близкие к 90 градусам, это было следствием влияния силы Кулоновского отталкивания.
Однако возникают два вопроса. Почему отрицательно заряженные электроны не притягиваются к ядру, которое заряжено положительно? Или почему электроны не разлетаются в разные стороны? Это объясняется квантовой физикой, что выходит за рамки классической физики. Достаточно лишь знать, что электроны удерживаются на своих орбитах электромагнитными взаимодействиями, а именно выполняется гипотеза Планка, о которой мы поговорим подробнее в следующем разделе.
Гипотеза Планка
Особенности излучения энергии атомами вещества, не подчиняющиеся законам классической физики и выявленные экспериментально, привели к новому этапу развития науки.
Основой новых представлений стала гипотеза, выдвинутая Максом Планком. Он предположил, что атом не может излучать энергию в виде непрерывной электромагнитной волны. Это предположение удивительно согласуется с результатами эксперимента, в результате которого видно, что излучение, испускаемое веществом, представляет собой набор полос с различными длинами волн.
Физик предположил, что поток энергии представляет собой отдельные порции — кванты. Энергия каждого кванта пропорциональна частоте излучения.
| \(E = hv =\frac{hc}{λ}\), где \(Е\) — энергия кванта (Дж); \(h\) — постоянная Планка; \(v\) — частота (Гц); \(с\) — скорость света (м/с); \(λ\) — длина волны (м). |
Одно из следствий излучения энергии ускоренным зарядом привело к интересному выводу: атом не может существовать, так как электрон, равномерно вращающийся вокруг ядра, должен в течение достаточно короткого интервала времени упасть на ядро. Это катастрофическое падение должно сопровождаться выбросом энергии и прекращением существования атома. Дать пояснение «ультрафиолетовой катастрофе» — предполагаемому явлению, вытекающему из планетарной модели атома, удалось на основании квантовых представлений, сформулированных Н. Бором и до сих пор носящих имя ученого.
Постулаты Бора
Как мы уже сказали, первое время модель атома Резерфорда вызывала множество вопросов, так как на тот момент люди еще не знали атомной природы. Планетарная модель практически потерпела крах, однако на помощь Э. Резерфорду пришел датский ученый Нильс Бор. Он ввел постулаты, которые дополняют модель атома Резерфорда.
Первый постулат Бора — электроны могут находиться только на определенных уровнях и обладать определенной энергией.

Считается, что самый ближний к ядру уровень имеет самую большую по модулю энергию, тем не менее эта энергия является отрицательной. Это значит, что для того, чтобы оторвать самый первый атом нам нужно приложить самую большую положительную энергию. Например, энергия на разных уровнях водорода:
\(E_n =\frac{-13,6 эВ}{n^2}\), где \(n\) — номер уровня.
Следовательно, чем выше уровень, тем меньше по модулю энергия электрона, а значит, тем проще оторвать его от ядра. На бесконечности электроны уже не связаны с ядром, а поэтому энергия уровня там равна нулю. Уровни в данном случае играют роль расстояния.
Вспомним в качестве аналогии электрические заряды, которые взаимодействуют друг с другом с силами, равными \(F=\frac{q^1q^2}{r^2}\) (подробнее об этой формуле смотрите в статье «Электростатика»): чем больше расстояние между зарядами, тем меньше взаимодействие между ними.
| Возможна ли телепортация в реальном мире? Она не только возможна, она существует с зарождения Вселенной! С помощью телепортации электроны перемещаются с одного уровня на другой. Для этого достаточно сообщить электрону необходимую энергию. В постулате говорится, что электрон существует строго на 1 орбите. Однако мы знаем, что электрон может перемещаться между орбитами. Несостыковка? А вот и нет! На самом деле электрон не просто переходит с одного уровня на другой, а телепортируется. Это не как «Одна нога тут, другая там», это сразу двумя ногами из одной точки в другую, без видимой траектории перемещения. Это научно доказанный факт. |
Второй постулат Бора — изменение уровня электрона означает изменение энергии и связано с поглощением/испусканием фотона.
Второй постулат Бора объясняет явление вырывания электрона с атома. Запишем соответствующие уравнения:
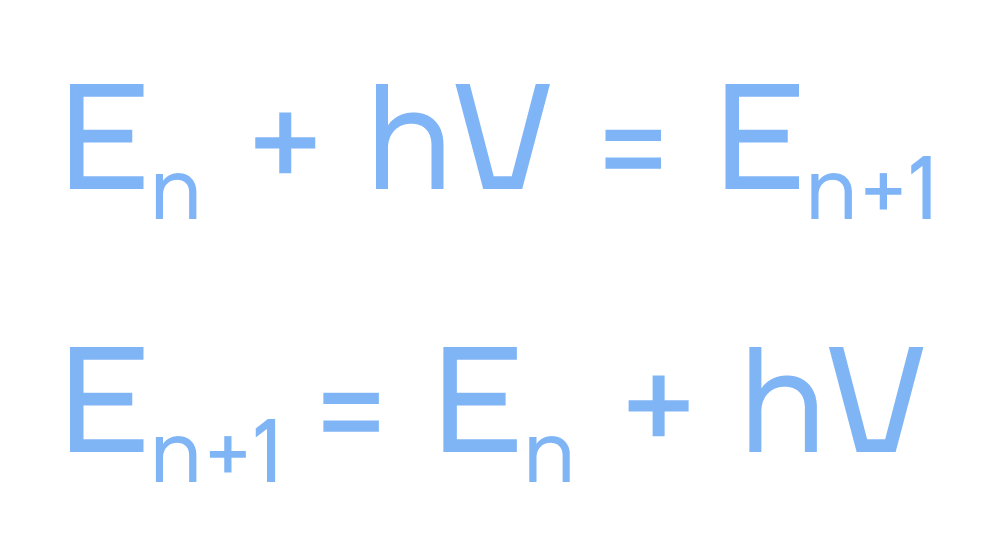
- Уравнение 1 — электрон идет на уровень выше (прилетел фотон и отдал энергию).
- Уравнение 2 — электрон идет на уровень ниже (вылетел фотон и забрал энергию).
В частности, второй постулат Бора говорит о том, что при переходе электрона с более низкого уровня на более высокий, например, с 1 на 3 или с 4 на 5, ему должен быть сообщен фотон строго определенной частоты. Никак не меньшей, иначе электрону не хватит энергии, чтобы перейти с одного уровня на другой.
Если же электрон опускается по уровням, например, с 5 на 2 или с 9 на 8, то он излучает фотон также строго определенной частоты.
Количество уровней энергии свое для каждого элемента и зависит от его положения в таблице Менделеева. Подробнее об этом будет рассказано в университете, а пока что ограничимся тем, что количество уровней связано с количеством s-, p-, d- и т.д. орбиталей, которые вы проходите на химии. До тех пор, пока электрон находится на уровне с конечным номером, он все еще связан с ядром, но как только электрон разрывает все связи, то он выходит на так называемый бесконечный уровень энергии.
Именно поэтому второй постулат Бора лучше записывать в двух вариантах. Да, с математической точки зрения они одинаковы, но с физической точки зрения они несут в себе разную информацию.
Итак, чтобы вырвать электрон из атома водорода (вывести его на бесконечный уровень), ему необходимо сообщить энергию E = 13,6 эВ.
Давайте попробуем разобрать пример задания №17 ЕГЭ.
Задание. Опираясь на схему энергетических переходов, дайте ответы на следующие вопросы:
А) Какая стрелка соответствует поглощению света наименьшей длины волны?
Б) Какая стрелка соответствует излучению наименьшей частоты?

Решение.
Запишем формулу для энергии: \(E_ф= hv =\frac{hc}{λ}\).
1) При поглощении света электрон стремится к нулевому уровню.
Следовательно, нам подходят стрелки 1 и 2.
Нас спрашивают про наименьшую длину волны. Значит, энергия фотона будет максимальной. Следовательно, электрону будет сообщена большая энергия.
Нам походит стрелка 2.
2) При излучении света электрон опускается по уровням. Следовательно, нам подходят стрелки 3 и 4.
Нас спрашивают про наименьшую частоту. Значит, по формуле энергия в таком переходе фотона будет минимальной. Выберем стрелку с наименьшей длиной. Нам подходит стрелка 4.
Ответ: 14
Точный расчет длин волн, сопровождающих переход электрона с одного энергетического уровня на другой, выполнен только для атома водорода. Итогом этого расчета стал набор линий, соответствующих различному диапазону длин волн: видимое излучение, ультрафиолетовое, инфракрасное и т.д. То есть при переходе атома с одного уровня на другой выделяется энергия, равная hv, эта энергия излучается в форме света, частота которого соответствует значению v из формулы. Зная частоту света, можно определить расположение уровня около ядра.
Определить длину волны соответствующего излучения можно при помощи формулы Ридберга.
| \(\frac{1}{λ}=R(\frac{1}{n^2}-\frac{1}{m^2})\), где \(R = 109 677 см−1\) — постоянная Ридберга для водорода; \(n\) — номер основного уровня; \(m\) — номер уровня, с которого происходит переход на основной; \(λ\) — длина волны (м). |
В таблице ниже предложены примеры серий спектральных линий для основных переходов.
| Название серии | Номер основного уровня | Номер уровня, соответствующего возбужденному состоянию | Диапазон длин волн |
| Серия Лаймана | 1 | 2; 3; 4; 5… | ультрафиолетовый |
| Серия Бальмера | 2 | 3; 4; 5… | видимый |
| Серия Пашена | 3 | 4; 5; 6; 7… | инфракрасный |
| Серия Брэккета | 4 | 5; 6; 7… | дальний инфракрасный |
| Серия Пфунда | 5 | 6; 7; 8… | дальний инфракрасный |
Итак, мы поговорили о строении атома с точки зрения квантовой механики, вернемся теперь к общему классическому представлению о нем.
Как мы выяснили выше, микрочастицы обладают не только малыми размерами, но и очень маленькой массой. Именно поэтому ученые ввели новую величину измерения для массы элементарных частиц.
Масса протона и нейтрона равна 1 а.е.м. (атомная единица массы), а масса электрона равна 0.
Именно в а.е.м. приведены массы элементов в таблице Менделеева.
Таблица Менделеева и как с ней работать
На первый взгляд, таблица Менделеева пестрит сочетаниями букв и цифр, но если разобраться — все не так уж сложно. Давайте рассмотрим, как мы можем узнать зарядовое число, массу и количество нейтронов по таблице Менделеева.
Для удобства введем следующие обозначения:
- А — массовое число. Количество нуклонов (протонов и нейтронов).
- Z — зарядовое число. Количество протонов или электронов.
- N — количество нейтронов. \(N = A — Z\).
Все элементы будем обозначать следующим образом:

Обозначим уже известные частицы:

Рассмотрим пример задания типа №16 ЕГЭ по использованию таблицы Менделеева для определения заряда и массы.
Задание. Найдите количество нейтронов в атоме лития.

1. В правом верхнем углу нам дан заряд элемента (он совпадает с порядковым номером элемента в таблице Менделеева), а в правом нижнем — масса элемента, которая при правильном округлении равна атомной массе.
2. Таким образом, заряд частицы \(Z = 3\), то есть ядро атома лития содержит 3 протона, а сам атом — 3 электрона.
3. При округлении массы получаем, что \(A = 7\), то есть общее число нуклонов (протонов и нейтронов) равно 7.
В подобных заданиях важно уметь пользоваться правилами округления. Если первая цифра после запятой равна 5 и более, то мы округляем в большую сторону, иначе оставляем только целую часть.
Пример: 34,4 = 34; 34,5 = 35.
4. Так как нейтронов и протонов вместе 7, а в ядре содержится 3 протона, то число нейтронов: \(N = A — Z = 7 — 3 = 4\).
Ответ: 4
Иногда ученики путаются, какая цифра за что отвечает. Но на самом деле все просто. Абсолютно у всех нейтральных элементов массовое число минимум в два раза больше, чем зарядовое. Можно запомнить это правило, чтобы никогда не путаться.
| Как труды Менделеева были обесценены безобидной шуткой? Некоторые люди до сих пор уверены, что многолетний и тяжелейший труд Менделеева просто приснился ему. Как вы уже поняли, речь идет о таблице Менделеева. На самом деле ученый потратил несколько плодотворных лет, чтобы представить Периодическую таблицу химических элементов в привычном виде. |
Примерно так выглядели его наработки:

Как мы видим, атом — это не просто микрочастица, обладающая новыми для нас свойствами. Атом — это целый новый мир со своими жителями: нейтронами, протонами и электронами, которые взаимодействуют друг с другом по правилам квантовой механики. Эти частицы поддерживают жизнедеятельность всего атома, подчиняясь постулатам Бора, устанавливающих законы существования планетарной модели Резерфорда.
Непросто сразу уложить все это в голове, поэтому будет правильным остановиться на этой статье на некоторое время, а затем заглянуть еще глубже — в ядро. Об этом поговорим в статье «Основы ядерной физики: строение ядра, ядерные силы».

Термины
Макромир — пространственная протяженность от размеров больших молекул до размеров Солнечной системы.
Микромир — пространственная протяженность порядка \(10^{-18}-10^{-8}\) м.
Фактчек
- Атом — самая маленькая часть химического элемента, состоящая из ядра и орбит, по которым движутся электроны.
- Планетарная модель Резерфорда — модель атома, в которой нейтроны и протоны сосредоточены в одном месте — ядре, вокруг которого вращаются электроны. В настоящее время модель атома Резерфорда считается правильной.
- Абсолютно у всех нейтральных элементов массовое число минимум в два раза больше, чем зарядовое. Исключением является лишь атом водорода.
- Постулаты Бора объясняют перемещение электрона между уровнями атома, а также его вырывание с атома.
Проверь себя
Задание 1.
Какая модель атома считается верной?
- модель пудинг с изюмом
- планетарная модель
- астрономическая
- модель Томпсона
Задание 2.
Чему равна масса электрона в а.е.м.?
- \(9,1*10^{-31}\)
- \(1,67*10^{-27}\)
- \(1\)
- \(0\)
Задание 3.
Сколько нейтронов содержится в атоме Брома?

- 35
- 80
- 45
- 115
Задание 4.
На энергетической диаграмме некоторого газа показан набор из четырех переходов атома между энергетическими состояниями. Определите, какому переходу соответствует наименьший импульс поглощенного фотона. В ответ запишите номер перехода. (Напомним, что наименьший импульс соответствует наименьшей энергии)

- 1
- 2
- 3
- 4
Задание 5.
На рисунке схематично представлены переходы атома водорода между различными энергетическими уровнями. Найдите среди них переход, при котором испускается фотон наибольшей частоты.

- 1
- 2
- 3
- 4
- 5
Ответы: 1. — 2; 2. — 4; 3. — 3; 4. — 1; 5. — 3.


 к списку статей
к списку статей






