
Привет! Это Богдан Чагин, я готовлю к ЕГЭ по химии учеников Умскул!

Однажды выпускник попросил у Вселенной задание по химии, где можно забрать халявные баллы. Вселенная исполнила его желание и добавила в КИМ №23.
И это не такая уж и сказка. Задание №23 ЕГЭ по химии куда проще, чем может показаться на первый взгляд, а получить за него ты сможешь целых два первичных балла.
В статье пошагово разобрали, как решать этот номер, чтобы ничего не упустить.
Задание №23 ЕГЭ по химии
Давай для начала прочитаем задачу.
В реактор постоянного объёма поместили некоторое количество оксида серы(IV) и кислорода. В результате протекания обратимой реакции
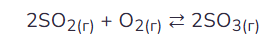
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы(IV) составила 1,2 моль/л, а равновесные концентрации кислорода и оксида серы(VI) составили 0,6 и 0,8 моль/л соответственно. Определите исходную концентрацию О2 (Х) и равновесную концентрацию SO2 (Y).
Теперь приступим к решению:
- На основе данных составляем таблицу.
Обычно это задание решают именно таким образом. В этой таблице будет исходная концентрация, равновесная концентрация, а также все вещества, которые являются участниками данной реакции, то есть реагенты и продукты.
| Вещество | SO2 | O2 | SO3 |
|---|---|---|---|
| Исходная концентрация, моль/л | 1,2 | ||
| Изменение в ходе реакции, моль/л | |||
| Равновесная концентрация, моль/л | 0,6 | 0,8 |
Обрати внимание: мы вводим новую строчку, где показываем, как меняются концентрации всех веществ до наступления равновесия. Это важное условие при решении задания. Здесь мы будем показывать, как увеличивается или уменьшается концентрация всех веществ.
Важный факт: в ходе реакции концентрация реагентов уменьшается, потому что они расходуются в ходе реакции, а концентрация продуктов увеличивается, потому что они в этой реакции образуются.
- По условию задачи определяем, какие вещества поместили в реактор, а какие — нет.
Смотрим на условие задания и видим, что вещество оксид серы(VI) изначально не поместили. Делаем вывод, что его исходная концентрация равна нулю.
| Вещество | SO2 | O2 | SO3 |
|---|---|---|---|
| Исходная концентрация, моль/л | 1,2 | 0 | |
| Изменение в ходе реакции, моль/л | |||
| Равновесная концентрация, моль/л | 0,6 | 0,8 |
- Если одно из веществ имеет исходную и равновесную концентрации, то находим изменение его концентрации.
У нас было 0 моль/л оксида серы(VI), стало 0,8 моль/л. В ходе реакции концентрация вещества увеличилась на 0,8 моль/л.
| Вещество | SO2 | O2 | SO3 |
|---|---|---|---|
| Исходная концентрация, моль/л | 1,2 | 0 | |
| Изменение в ходе реакции, моль/л | +0,8 | ||
| Равновесная концентрация, моль/л | 0,6 | 0,8 |
Все числа, которые мы используем в строчке «Изменение в ходе реакции», будем вносить в уравнение реакции и проводить расчёт.
- Проводим расчёт по уравнению реакции.
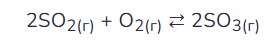
Как мы это делаем? Над формулой, которая дана, мы пишем изменяющуюся в ходе реакции концентрацию и по пропорции смотрим, сколько наших реагентов потребуется для проведения такой реакции.
У нас было два оксида серы(IV), из которых получилось два оксида(VI). Соотношение один к одному. Из двух оксидов получили два оксида, соответственно, из трёх получим три и так далее. Тогда, чтобы получить 0,8, нам нужно взять столько же, 0,8. Следовательно, в ходе реакции у нас израсходовалось 0,8 моль/л.
| Вещество | SO2 | O2 | SO3 |
|---|---|---|---|
| Исходная концентрация, моль/л | 1,2 | 0 | |
| Изменение в ходе реакции, моль/л | −0,8 | +0,8 | |
| Равновесная концентрация, моль/л | 0,6 | 0,8 |
Точно так же считаем, сколько кислорода у нас прореагировало в ходе этой реакции. У кислорода коэффициент 1, у оксида серы(VI) коэффициент 2. Получается, что на один кислород требуется два оксида. Из одного кислорода образуется в два раза больше оксида, соответственно, кислорода в два раза меньше, поэтому 0,8 делим на 2. Для того чтобы получить 0,8 моль/л оксида серы(VI), нам нужно в два раза меньше кислорода: 0,8 : 2 = 0,4.
| Вещество | SO2 | O2 | SO3 |
|---|---|---|---|
| Исходная концентрация, моль/л | 1,2 | 0 | |
| Изменение в ходе реакции, моль/л | −0,8 | −0,4 | +0,8 |
| Равновесная концентрация, моль/л | 0,6 | 0,8 |
- Имея все нужные данные, находим X и Y.
Делаем это путём расчётов по составленной таблице. SO2 было 1,2 моль/л, израсходовалось 0,8, осталось 0,4.
| Вещество | SO2 | O2 | SO3 |
|---|---|---|---|
| Исходная концентрация, моль/л | 1,2 | 0 | |
| Изменение в ходе реакции, моль/л | −0,8 | −0,4 | +0,8 |
| Равновесная концентрация, моль/л | Y = 0,4 | 0,6 | 0,8 |
Что касается кислорода, его у нас осталось 0,6, израсходовано при этом 0,4. Соответственно, от какого числа нужно отнять 0,4, чтобы получить 0,6? От единицы.
| Вещество | SO2 | O2 | SO3 |
|---|---|---|---|
| Исходная концентрация, моль/л | 1,2 | X = 1 | 0 |
| Изменение в ходе реакции, моль/л | −0,8 | −0,4 | +0,8 |
| Равновесная концентрация, моль/л | Y = 0,4 | 0,6 | 0,8 |
Таким образом, получаем ответ: исходная концентрация О2 равна 1, а равновесная концентрация SO2 — 0,4.
Надеюсь, теперь тебе всё понятно! Еще больше разборов заданий, теории и практики — на курсах в онлайн-школе «Умскул»! Приходи на бесплатную консультацию, чтобы узнать подробности:

 к списку статей
к списку статей 


